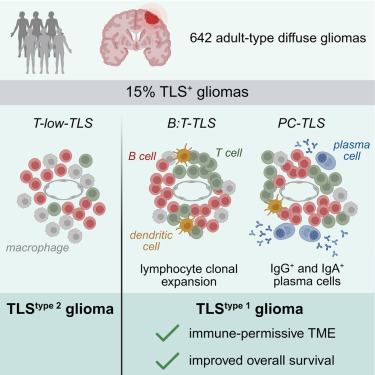
文献分享:功能性三级淋巴结构胶质瘤亚群的空间解析
背景
在胶质瘤治疗领域,免疫治疗发展始终受限于对肿瘤免疫微环境的模糊认知。作为中枢神经系统最具侵袭性的恶性肿瘤,胶质瘤尤其是胶质母细胞瘤(GBM),长期被贴上免疫冷肿瘤标签。血脑屏障阻碍免疫细胞浸润、肿瘤细胞高表达PD-L1等免疫检查点分子、大量M2型巨噬细胞等免疫抑制性细胞富集,这些因素导致免疫检查点抑制剂等疗法临床响应率不足15%。三级淋巴结构(TLS)是组织局部自发形成的异位淋巴组织,在实体瘤中已被证实是免疫热肿瘤的核心标志,能够通过招募并活化T细胞与B细胞构建持续性抗肿瘤免疫应答,与黑色素瘤、肺癌等肿瘤患者的良好预后密切相关。然而,胶质瘤中是否存在功能性TLS、其空间特征及临床意义如何,始终缺乏明确答案。“Spatial immune profiling defines a subset of human gliomas with functional tertiary lymphoid structures” 一文的核心突破,在于利用多重免疫荧光mIF技术的空间解析能力,首次在人类胶质瘤中鉴定出存在功能性TLS的独特亚群,为胶质瘤免疫微环境研究及免疫治疗靶点开发提供颠覆性视角。TLS的精准鉴定面临两大技术瓶颈,一是TLS定义需多谱系细胞的特定空间排布,传统单标免疫组化IHC依赖连续切片推断易出错,流式细胞术则会丢失空间信息。二是功能性TLS需同步检测细胞身份标志物与功能标志物,传统技术难以实现单细胞水平多参数共定位。针对这些瓶颈,研究团队选择基于酪胺信号放大TSA技术的多重免疫荧光技术(mIF)平台,该平台具备高灵敏度、多靶点同步检测及空间信息完整保留的优势,可通过辣根过氧化物酶HRP催化荧光素共价结合实现百倍信号放大,检出低丰度功能标志物,且多轮染色洗脱循环能在同一张FFPE切片上完成6至8种靶点检测,完美匹配TLS多维度鉴定需求。
实验设计
研究围绕TLS的精准识别与功能验证,构建标准化mIF技术体系,核心从靶点组合、染色成像及定量分析三方面实现创新优化。文章设计两组互补标志物检测通道,一组含CD3、CD4、CD8(T细胞亚群)、CD20(B细胞)、CD21(滤泡树突状细胞)及DAPI,通过多色荧光共定位,明确T细胞围绕B细胞滤泡、CD21⁺细胞形成网络的典型TLS形态,解决TLS定性问题。mIF多色叠加优势避免了传统单标染色的细胞定位误差。另一组含Ki-67(增殖)、PAX5(B细胞成熟)、IgG(抗体分泌)、CD138(浆细胞标志),可观察到PAX5⁺成熟B细胞、Ki-67⁺增殖细胞及CD138⁺IgG⁺浆细胞的空间分布,证实TLS内活跃的免疫应答,完成功能性TLS的核心验证。
为规避信号串扰与假阳性,研究建立严格实验规范,核心优化包括:染色顺序适配表位稳定性:按CD21、CD20(表位稳定)至CD3、CD8(表位易降解)的顺序染色,搭配温和抗原修复条件,确保多轮循环后阳性检出率超80%。荧光染料优化光谱分离:选用光谱重叠度<5%的Opal系列染料,结合多光谱成像系统的解卷积算法,单标与多标检测相关系数r>0.92,保障染色特异性。全切片成像与精准圈选:20×物镜全扫避免TLS微小结构遗漏,结合数字病理软件圈选目标区域,确保定量对比的准确性。
TLS在瘤内血管周围微环境的分布与功能关联
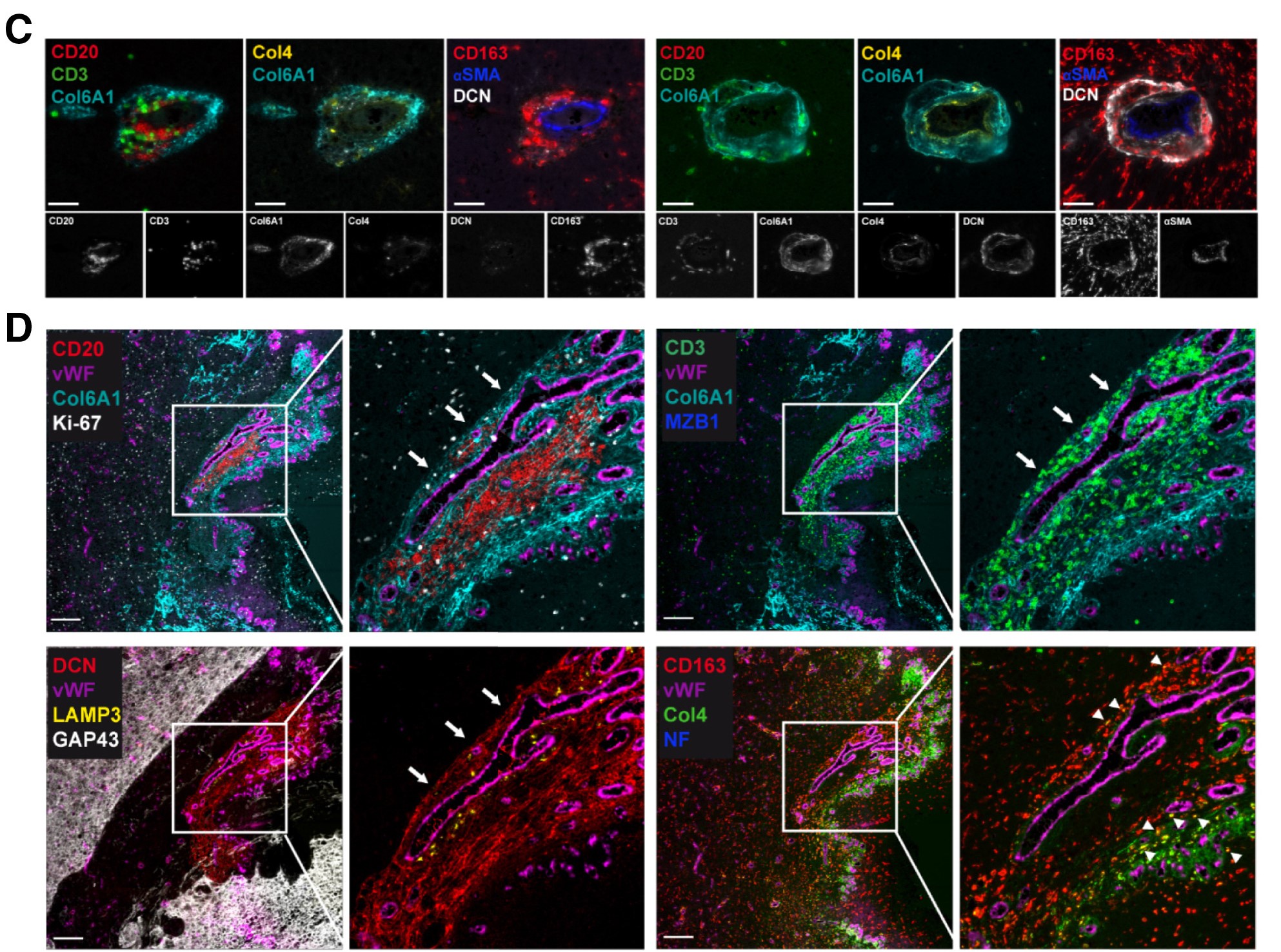
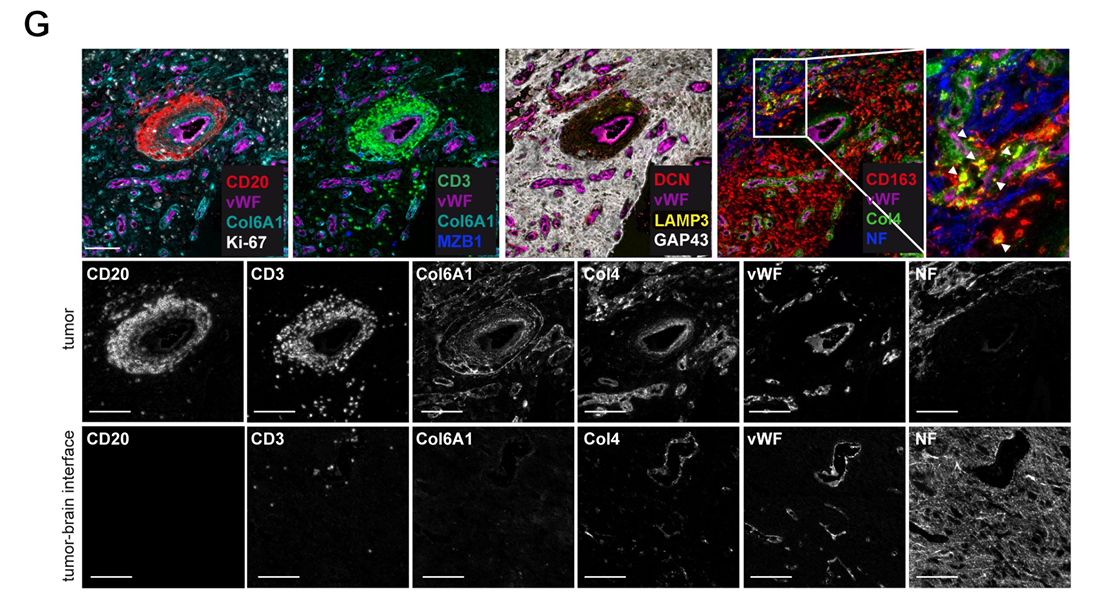
通过多重标志物组合的免疫荧光技术,图C在血管周围微环境中清晰呈现了 CD20⁺B 细胞与 CD3⁺T 细胞的分布,同步展示了 Col6A1、Col4、DCN 等细胞外基质成分、αSMA 及 CD163 的表达定位并提供对应单通道图像,明确了细胞与基质成分的空间关联。图 D 则进一步明确 TLS 聚集于富含 Col6A1⁺的致密细胞外基质中且紧邻 vWF⁺血管,高倍图像显示 CD20⁺B 细胞与 CD3⁺T 细胞的聚集形态,同时揭示 TLS 内包含 Ki67⁺增殖细胞、MZB1⁺活化分化 B 细胞、LAMP3⁺树突状细胞等功能活性细胞与各类基质成分,发现 CD163⁺Col4⁺双阳性巨噬细胞提示肿瘤相关巨噬细胞对 Col4 基质成分的摄取,且神经丝蛋白表达缺失结合 GAP43 分布证实该 TLS 位于肿瘤内部。图G中关键发现为 Col6A1 在非肿瘤区域中不表达。
胶质瘤相关 TLS 的结构功能特征与成熟度评估
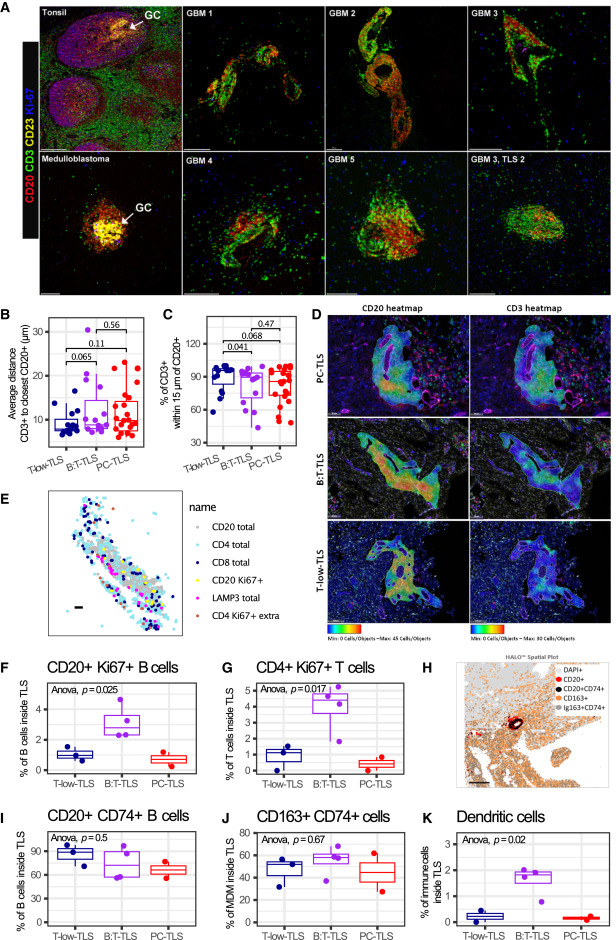
通过多重免疫荧光技术及定量分析,揭示胶质瘤相关TLS的核心特征。结果显示6例胶质瘤相关TLS均无对照组(扁桃体、髓母细胞瘤)中高表达Ki67和CD23的典型生发中心,且未检测到CD23⁺滤泡树突状细胞,部分亚型(B:T-TLS、PC-TLS)呈现T/B细胞分区聚集特征,T-low-TLS中T/B细胞混合分布更明显。所有TLS亚型均存在增殖性CD20⁺Ki67⁺B细胞和CD4⁺Ki67⁺T细胞,其中B:T-TLS中增殖比例最高,且TLS内多数B细胞和部分巨噬细胞表达CD74,B:T-TLS中LAMP3⁺树突状细胞占比显著高于其他亚型,同时存在滤泡辅助T细胞表型。部分TLS阳性肿瘤中AICDA、CR2等成熟标志物转录水平低且表达不一致,表明胶质瘤相关TLS成熟度有限,缺乏典型生发中心样反应。
胶质瘤相关TLS中B细胞向浆细胞的分化
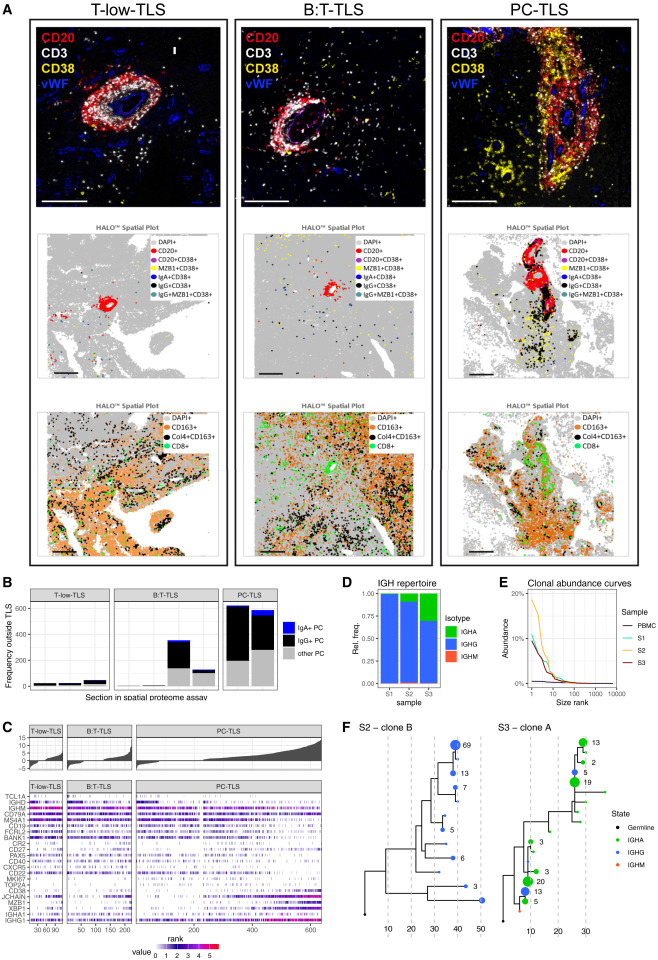
通过多重 mIF 检测显示,TLS内外均存在 IgG⁺CD38⁺MZB1⁺和 IgA⁺CD38⁺MZB1⁺类转换浆细胞,且 PC-TLS 及部分 B:T-TLS 中 TLS 及其周边浆细胞比例最高。空间单细胞转录组分析表明,三种 TLS 亚型中均存在从成熟初始 B 细胞(TCL1A、IGHD⁺)到记忆样 B 细胞(IGHG1、CD27⁺)再到浆母细胞样 B 细胞(CD19、CD38⁺)的连续分化阶段,高分化浆细胞(高表达 IGHG/IGHA 及 MZB1,低表达 CD19、MS4A1)主要富集于 PC-TLS。对 TLS 阳性胶质瘤的免疫球蛋白重链测序显示,其免疫球蛋白库以 IgG 为主、IgA 为辅,与 mIF 及转录组结果一致,且存在源于同一 VDJ 重组事件的扩增克隆家族,这些克隆家族包含多种免疫球蛋白亚型并伴随广泛体细胞高频突变。综上,结果证实胶质瘤组织内存在活跃的初始 B 细胞向浆细胞及记忆 B 细胞分化的过程,且该过程伴随克隆 B 细胞家族的亲和力成熟与类别转换重组。
总结
本研究通过多模态分析,明确成人型弥漫性胶质瘤中存在三种分化状态各异的 TLS 亚型,全面评估了 TLS 的临床相关性及成熟相关特征,鉴定出以功能性 TLS(B:T-TLS 和 PC-TLS)富集为特征的 TLStype 1胶质瘤亚型,该亚型具备免疫许可性微环境且患者生存期更长。同时提出基于病理组织切片的免疫荧光筛选检测方法,可为胶质瘤免疫分型及免疫治疗应答预测提供生物标志物,为GBM免疫治疗试验中的患者分层及 TLS 诱导 或成熟靶向疗法开发提供重要参考。
参考文献
Cakmak P, Lun JH, Singh A, Macas J, Schupp J, Schuck J, Mahmoud Z, Köhler M, Starzetz T, Burger MC, Steidl E, Hasse LM, Hattingen E, Plate KH, Reiss Y, Imkeller K. Spatial immune profiling defines a subset of human gliomas with functional tertiary lymphoid structures. Immunity. 2025 Nov 11;58(11):2847-2863.e8. doi: 10.1016/j.immuni.2025.09.018. Epub 2025 Oct 21. PMID: 41125076.
Enkilife mIF 技术服务
提供有偿代检和分析服务
承接多色配套服务
分类 | 服务项目 | 备注 |
|---|---|---|
IHC染色 | IHC单色标记 | |
IF荧光染色 | 免疫荧光单标 | 不含一抗,含二抗(兔/小鼠/大鼠)、DAPI。 四标以上染色需要提供多余白片做单标预实验。 |
荧光多标染色 | ||
全景扫描 | 免疫组化全景扫描 | 提供读片软件及原始相关文件,荧光扫描波长范围。 |
荧光标记全景扫描 | ||
数据分析 | 免疫组化及免疫荧光切片分析 | 可进行全片单阳性、多阳性细胞数及面积分析,也可定制分析特征病理区域,或进行空间分析、位置分析等。 |
